
Гильфанова Эльмира Газизяновна
учитель химии
МБОУ «Камскополянская средняя общеобразовательная школа №2
с углублённым изучением
отдельных предметов» НМР РТ
пгт Камские Поляны, Республика Татарстан
Цель: изучить химические и физические свойства неорганических кислот.
Планируемые результаты
Предметные
– определение, состав кислот и их классификацию;
– правила техники безопасности при работе с кислотами;
– важнейшие неорганические кислоты.
– Кислотный остаток;
– Систематическая (IUPAC) и историческая номенклатура неорганических кислот;
– Индикаторы
– определять валентность кислотного остатка и составлять формулы кислот; распознавать – кислоты с помощью индикаторов;
– использовать возможности ИКТ, Интернет-ресурсов и других информационных источников для выполнения домашних заданий и представления результатов.
Метапредметные
Регулятивные УДД:
– Составление плана достижения цели, осознанный выбор наиболее эффективных способов решения учебных и познавательных задач.
– Владение основами самоконтроля и самооценки.
Познавательные УДД:
– Умение выбирать смысловые единицы текста и устанавливать отношения между ними.
– Самостоятельное выделение и формулирование познавательной цели.
– Умение определять понятия, устанавливать аналогии.
Коммуникативные УДД:
– Умение обмениваться знаниями между членами группы для принятия эффективных совместных решений.
– Умение формулировать собственное мнение и позицию, аргументировать их.
– Формирование и развитие компетентности в области использования ИКТ.
Личностные:
– Демонстрация ответственного отношения к обучению и проявление интереса к предлагаемой деятельности с учётом собственных интересов.
– Осознанное осмысление обучающимися связи между целью учебной деятельности и ее мотивом.
– Развитие навыков сотрудничества с учителем и сверстниками в разных учебных ситуациях.
Тип урока: комбинированный
Методы обучения: Частично-поисковый, проблемный.
Оборудование: ноутбук, сайт «Инфоурок», презентация,
Ход урока
(сайт «Инфоурок)
Учитель: Добрый день ребята!!! Все успели подключиться к уроку?
Мы продолжаем изучать классы неорганических соединений.
– Давайте вспомним классификацию кислот…. (ответы учащихся)
Презентация для уточнения ответов учащихся
- Кислоты бывают по происхождению: органические и неорганические

- Кислоты можно разделить на две группы: кислородсодержащие и бескислородные.
Кислоты.
|
Бескислородные 1.Одноосновные. HCl – соляная. HBr – бромоводородная. 2. Двухосновные. H2S – сероводородная. |
Кислородсодержащие. 1.Одноосновные. HNO3 – азотная. HNO2 – азотистая. 2. Двухосновные. H2SO4 – серная. H2SO3 – сернистая. H2СO3 – угольная. 3. Трехосновные. H3PO4 – ортофосфорная. H3ВO3 – борная. |
- Кислоты делятся на группы: одноосновные; двухосновные; трехосновные. (зависит от числа атомов водорода)
1.Одноосновные.
HNO3 – азотная.
HNO2 – азотистая.
2. Двухосновные.
H2SO4 – серная.
H2SO3 – сернистая.
H2СO3 – угольная.
3. Трехосновные.
H3PO4 – ортофосфорная.
H3ВO3 – борная
Тема урока: Физические и химические свойства кислот
(записать в тетради тему)
Кислоты — это электролиты, которые диссоциируют в растворах на катионы водорода и анионы кислотных остатков. (записать в тетрадь)
Физические свойства (записать)
– Какие пищевые кислоты вы знаете?
- уксусная кислота,
- лимонная кислота,
- муравьиная кислота,
- щавелевая кислота
- молочная кислота
– Как вы думаете почему их так назвали? (Все кислоты обладают кислым вкусом)
- Какие агрегатные состояния веществ вы знаете из курса физики? (газообразное, жидкое, твердое)
H2SO4 – жидкость; H3BO3 – твердое.
(записать в тетрадь)
– кислые на вкус
– кислоты жидкости или твёрдые вещества
Химические свойства (записать)
- Действие индикаторов (записать)
Растворы кислот способны изменять окраску некоторых веществ.
Вещества, которые изменяют свою окраску в зависимости от среды раствора называются – индикаторами. (записать в тетрадь)
Окраску растворов трех индикаторов в кислой среде вам нужно запомнить.
Посмотрите видео и заполните таблицу
|
Индикатор |
Нейтральная |
Кислая |
Щелочная |
|
Метилоранжевый |
|||
|
Фенолфталеин |
|||
|
Лакмус |
(Для самопроверки)

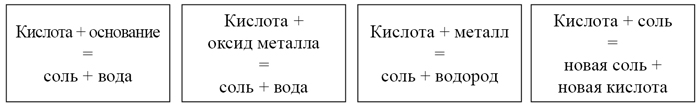
- Взаимодействие кислот с металлами. (записать)
Посмотрите эксперимент!!!!!!!!Ответьте на вопрос.
По какому признаку мы можем судить, что эксперимент состоялся? (выделение газа – признак химической реакции)
(Запишите в тетрадь)
-
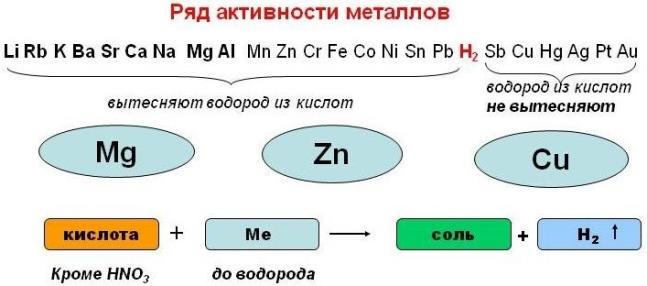
- Металлы, стоящие в ряду электроотрицательности металлов после водорода, не реагируют с растворами кислот.
- Металлы, стоящие левее в ряду электроотрицательности металлов более активны металлов, стоящих правее. (записать в тетрадь)
- Взаимодействие с оксидами металлов.
Посмотрите эксперимент!!!!!!!!
CuО + H2SO4 = CuSO4 + H2О
Голубой
осадок
Реагируют с основаниями – реакция нейтрализации
H3PO4 + 3NaOH = Na3PO4 + 3H2O
- Взаимодействие кислоты с солями
Посмотрите эксперимент!!!!!!!!
https://www.youtube.com/
Реакции обмена между кислотами и солями возможны, если в результате образуется практически нерастворимое в воде вещество (выпадает осадок), образуется летучее вещество (газ) или слабый электролит.
(Записать в тетрадь)
А) Кислоты реагируют с растворами солей, если в результате реакции один из продуктов выпадает в осадок.
H2SO4+BaCl2→BaSO4↓+2HCl
Na2SiO3+2HNO3→H2SiO3↓+2NaNO3.
Б) Продукт реакции при обычных условиях, либо при нагревании, улетучивается.
FeS+2HCl→FeCl2+H2S↑.
В) Если кислота, которая вступает в реакцию, является сильным электролитом, то кислота, которая образуется — слабым.
2HCl+CaCO3→CaCl2+H2O+CO2↑
- Запомните!
Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду:
H2CO3 ↔ H2O + CO2↑
H2SO3 ↔ H2O + SO2↑
(Записать в тетрадь) Способы получения кислот
|
бескислородные |
кислородсодержащие |
|
HCl, HBr, HI, HF, H2S |
HNO3, H2SO4 и другие |
|
ПОЛУЧЕНИЕ |
|
H2+Cl2= 2HCl |
SO3+H2O =H2SO4 |
|
2. Реакция обмена между солью и менее летучей кислотой 2 NaCl (тв.) + H2SO4(конц.) = Na2SO4+ 2HCl |
|
IV. Домашнее задание.
1. Дописать уравнение реакции
Zn + H2SO4 =
Zn + HCl =
Hg + H3PO4 =
CuO + HCl =
Fe2O3 + H3PO4 =
NaOH+H2SO4 =
2. Изучить П.39 выполнить упражнения в конце параграфа



